「水素」と「酸素」を化学反応させて発電する『燃料電池』
燃料電池とは?
「水素」と「酸素」を化学反応させて、直接「電気」を発電する新しい概念の発電装置です。燃焼により一旦熱に変換する従来からの熱機関従来の発電方式より高い効率が期待できます。「電池」という名前はついていますが、蓄電池のように充電した電気を溜めておくものではありません。燃料電池の燃料となる「水素」は、天然ガスやLPG、メタノールなどを改質して作るのが一般的でしたが、カーボンニュートラルに向けて、最近は再生可能エネルギーによる電気分解やバイオマスを原料とした製造方法の実用化が進められています。「酸素」は、空気中から取り入れます。水素と空気の供給を続ける限り継続して発電が可能となります。また、発電と同時に熱も発生しますので、その熱を活かすことでエネルギーの総合利用効率をさらに高めることが可能です。
『燃料電池』のしくみ
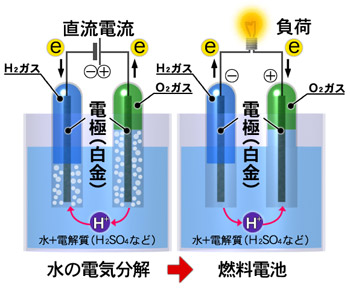
水の電気分解と発電の仕組み
外部から供給された水素分子(H2)は、マイナスの電極内にある触媒上で活性な水素原子(H-H)となります。この水素原子は、水素イオン(2H+)となり2個の電子(2e-)を電極へ送り出します。電子を引き抜かれてプラスの電荷を帯びた水素イオン(2H+)は、プロトンのみが透過できる電解質を伝ってプラスの電極に移動します。プラスの電極では、外部から供給された酸素分子(O2)が外部回路から供給される電子を受け取り酸素イオン(O2-)となり、電解質を通過してきた水素イオンと結合して水を生成します。この時、マイナス極から取り出されたた電子をプラス極へ移動させる外部回路をつなげると、そこに電流が流れ発電されることになります。
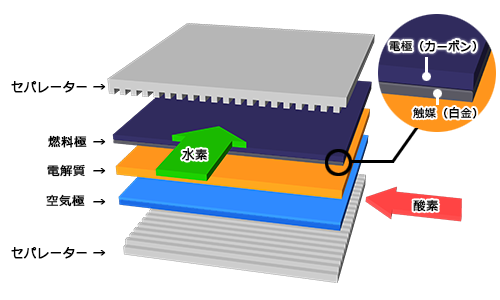
燃料電池の基本構成
燃料電池の構成単位をセル(単電池ともいいます)といいます。セルは平たい乾電池のようにプラスの電極板(空気極)とマイナスの電極板(燃料極)が固体高分子膜(電解質膜)をはさんだ構造をしています。空気極と燃料極の外側には数多くの細い溝が掘られているセパレーターが配置され、ここを外部から供給された酸素(空気:酸素は空気中に約20%含まれています)と水素が通ることによって、反応が起こります。水素は電解質膜と接する面まで入り込んで、電子を遊離して水素イオンとなり、電子は外に出て行きます。電解質膜中を移動した水素イオンは、反対側の電極に送られた酸素と外部から電線を通じて戻ってきた電子と反応して水になります。この電子とイオンに分かれるところが燃料電池の原理の重要な点です。電子が電線を移動することは、電流が流れること、すなわち電気が発生することになるのです。
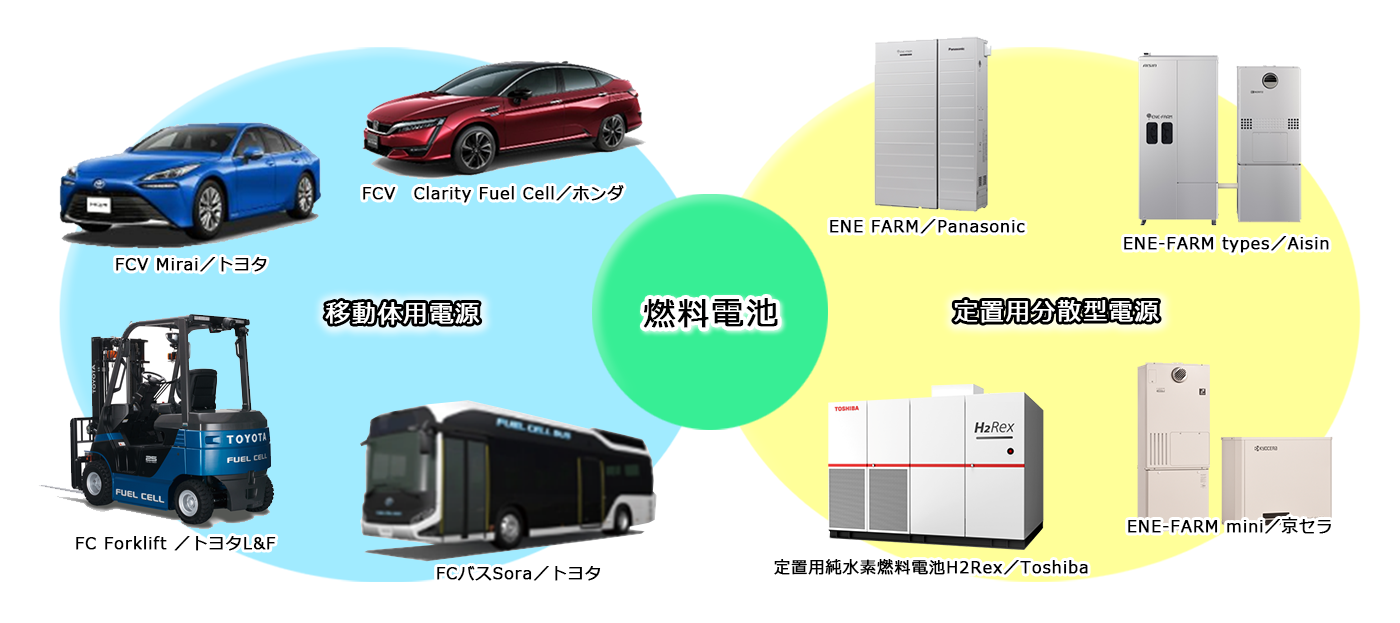
「燃料電池」はいろいろな用途がある革新的なエネルギー技術です。
燃料電池は、小規模でも大規模発電所をしのぐ高い発電効率が可能で排気ガスもクリーンなことから、乗用車やバスをはじめとする移動体を駆動させる電源や、工場、オフィスビルや家庭用などの分散型発電機として活用が始まっており、燃料電池自動車(FCV)や家庭用燃料電池エネファームなどが実用化されています。さらに2050年のカーボンニュートラル化に向けて、大型トラックをはじめ船舶、鉄道、産業用機器、またスマートコミュニティーなど幅広い分野でのCO2排出削減に貢献する優れた革新的技術として、研究開発から社会実証まで、国や民間企業でさまざまな取り組みが進められています。
- メリット1 環境に優しい ⇒
- 発電の際には水しか排出されず、振動も騒音もありません。
- メリット2 高効率 ⇒
- 電気と同時に熱も利用できるので、総合エネルギー効率が高くなります。
- メリット3 温室効果ガス排出低減 ⇒
- 燃料の水素は化石燃料からのみならず、再生可能エネルギーによる電気分解やバイオマス等、さまざまな方法で水素を取り出すことができます。
より詳しい情報は ⇒ 水素エネルギーナビ
